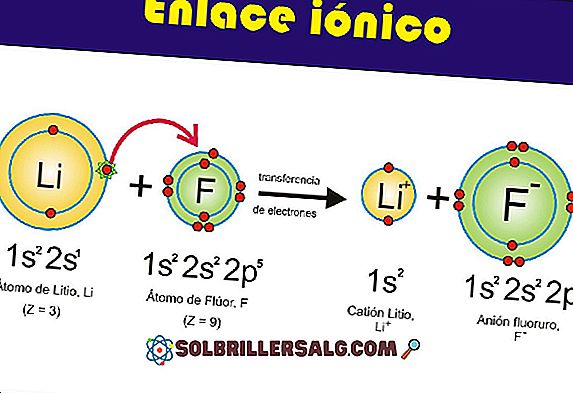
Hexokinase คืออะไร
Hexokinase เป็นโปรตีนที่จัดอยู่ในกลุ่มหลักของเอนไซม์ transferase ซึ่งมีความสำคัญในการเผาผลาญสิ่งมีชีวิต

Hexokinase เป็นเอนไซม์ตัวแรกในเส้นทางไกลโคไลติกและเปลี่ยนกลูโคสเป็นกลูโคส -6- ฟอสเฟต มันใช้ ATP เพื่อ phosphorylate กลุ่ม 6-hydroxyl กลูโคสและถูกยับยั้งโดยผลิตภัณฑ์กลูโคส -6- ฟอสเฟต นอกจากนี้ยังทนทุกข์ทรมานจากการควบคุม allosteric เชิงบวกโดยฟอสเฟต
ดังนั้น hexokinase จะควบคุมการไหลของกลูโคสในการเผาผลาญพลังงานของสมองและเซลล์เม็ดเลือดแดง
กลูโคส -6- ฟอสเฟตและกลูโคสผูกเข้าด้วยกันกับ hexokinase เช่นเดียวกับกลูโคสและฟอสเฟตอนินทรีย์
ฟอสเฟตมีบทบาทเล็กน้อยในการควบคุมเฮกซาไคเนสระหว่างการหายใจเนื่องจาก glycolysis ถูก จำกัด โดยการจัดหากลูโคส
ในช่วงระยะเวลาของการกีดกันออกซิเจนเอทีพีมากขึ้นจะต้องมาจาก glycolysis เนื่องจากไพรูเวตกลายเป็นกรดแลคติกแทนการเข้าสู่วงจร Kreb
เมื่อความเข้มข้นของกลูโคสนอกเซลล์ประมาณ 5 mM การไหลผ่านทางเดินไกลโคนจะเพิ่มความจุได้ถึง 100%
สิ่งนี้เกิดขึ้นทุกครั้งที่เนื้อเยื่อขนย้ายเนื้อเยื่อกลูโคสในสมองยกระดับความเข้มข้นของน้ำตาลในเซลล์โดย 50 เท่าและมีกลไกในการชดเชยผลการยับยั้งของกลูโคส -6- ฟอสเฟตบนเฮกซาไคเนส
คุณสมบัติของ hexokinase
Hexokinase เป็น Homodimer ขนาดใหญ่ที่ประกอบด้วยกรดอะมิโน 920 ตัวในแต่ละห่วงโซ่ เนื่องจากทั้งสองกระทู้เหมือนกันจะมีการสังเกตห่วงโซ่
นี่คือมุมมองของโครงสร้างสีตั้งแต่สีอ่อนไปจนถึงสีเข้มในทิศทาง N-terminal ถึง C-terminal
เอนไซม์นี้ประกอบไปด้วยอัลฟาเอนริเก้และเบต้าเบตา เอนจิ้นอัลฟานั้นเกิดจากโครงสร้าง helix-turn-helix และการมองอย่างใกล้ชิดกับแผ่นเบต้าจะบ่งบอกว่าพวกมันเป็นแผ่นอัลฟา / เบต้าแบบเปิด
Hexokinase สามารถจับกับลิแกนด์สองกลูโคสและกลูโคส -6- ฟอสเฟต กลูโคสถูกผูกไว้เพื่อให้ไกลคอลสามารถเกิดขึ้นได้และกลูโคส -6- ฟอสเฟตผูกเป็นตัวยับยั้ง allosteric นอกจากนี้ยังมีประโยชน์ที่จะเห็นโครงสร้างนี้ในระบบสเตอริโอ (Schroering, 2013)
โครงสร้างระดับอุดมศึกษาของ hexokinase รวมถึงแผ่นอัลฟา / เบต้าแบบเปิด มีการเปลี่ยนแปลงจำนวนมากที่เกี่ยวข้องกับโครงสร้างนี้
ประกอบด้วยแผ่นเบต้าห้าแผ่นและตัวช่วยสามตัว ในแผ่นอัลฟ่า / เบต้าเปิดนี้แผ่นเบต้าสี่แผ่นนั้นขนานกันและหนึ่งแผ่นอยู่ในทิศทางต่อต้านขนาน
alpha helices และ beta loops เชื่อมต่อแผ่นงานเบต้าเพื่อสร้างแผ่นงานเปิดแบบ alpha / beta นี้ แหว่งระบุโดเมนที่มีผลผูกพันกับ ATP ของเอนไซม์ glycolytic นี้ (Schneeberger, 1999)
ปฏิกิริยา
เพื่อที่จะได้รับผลตอบแทน ATP สุทธิจาก catabolism ของกลูโคสเป็นสิ่งแรกที่จำเป็นในการย้อนกลับ ATP
ในระหว่างขั้นตอนกลุ่มแอลกอฮอล์ในตำแหน่งที่ 6 ของโมเลกุลกลูโคสจะทำปฏิกิริยากับกลุ่มฟอสเฟตเทอร์มินัลของ ATP ได้อย่างง่ายดายกลายเป็นกลูโคส -6-phosphate และ ADP

เพื่อความสะดวกกลุ่มฟอสฟอรัส (PO32-) จะถูกแทนด้วยⓅ เนื่องจากการลดลงของพลังงานฟรีมีขนาดใหญ่มากปฏิกิริยานี้จึงไม่สามารถย้อนกลับได้ในสภาพร่างกาย
ในสัตว์ฟอสโฟรีเลชั่นของกลูโคสซึ่งผลิตกลูโคส 6 ฟอสเฟตนั้นจะถูกเร่งด้วยเอนไซม์สองชนิดที่แตกต่างกัน
ในเซลล์ส่วนใหญ่ hexokinase ที่มีความสัมพันธ์สูงสำหรับกลูโคสจะทำให้เกิดปฏิกิริยา
นอกจากนี้ตับยังมี glucokinase (isoform IV ของ hexokinase) ซึ่งต้องการความเข้มข้นของกลูโคสที่สูงกว่ามากก่อนที่จะทำปฏิกิริยา
กลูโคคิเนสทำงานได้เฉพาะในกรณีฉุกเฉินเมื่อความเข้มข้นของกลูโคสในเลือดเพิ่มขึ้นถึงระดับสูงผิดปกติ (Kornberg, 2013)
การควบคุม
ใน glycolysis ปฏิกิริยาที่เร่งปฏิกิริยาโดย hexokinase, phosphofructokinase และ pyruvate kinase ไม่สามารถแก้ไขได้จริง; ดังนั้นจึงคาดว่าเอนไซม์เหล่านี้จะมีบทบาทด้านกฎระเบียบและตัวเร่งปฏิกิริยา ในความเป็นจริงแต่ละคนทำหน้าที่เป็นเว็บไซต์ควบคุม
Hexokinase ถูกยับยั้งโดยผลิตภัณฑ์กลูโคส 6 ฟอสเฟต ความเข้มข้นสูงของโมเลกุลนี้บ่งชี้ว่าเซลล์ไม่ต้องการกลูโคสสำหรับพลังงานอีกต่อไปสำหรับการเก็บเป็นไกลโคเจนหรือเป็นแหล่งกำเนิดสารตั้งต้นทางชีวสังเคราะห์และกลูโคสจะถูกทิ้งไว้ในเลือด
ตัวอย่างเช่นเมื่อฟอสฟอสโฟไคน์เนสไม่ได้ใช้งานความเข้มข้นของฟรุกโตส 6- ฟอสเฟตจะเพิ่มขึ้น
ในทางกลับกันระดับกลูโคส 6- ฟอสเฟตเพิ่มขึ้นเนื่องจากอยู่ในสมดุลกับฟรุกโตส 6-phosphate ดังนั้นการยับยั้งฟอสฟอโรมิโนไคเนสจึงนำไปสู่การยับยั้งเฮกซาคินเนส
อย่างไรก็ตามตับซึ่งมีบทบาทในการติดตามระดับน้ำตาลในเลือดนั้นมีคุณสมบัติเป็นไอโซไซม์พิเศษของ hexokinase ที่เรียกว่า glucokinase ซึ่งไม่ถูกยับยั้งโดยกลูโคส -6- ฟอสเฟต (Berg JM, 2002)
Hexokinase vs glucokinase
Hexokinase มีไอโซฟอร์มที่แตกต่างกันสี่แบบที่เรียกว่า I, II, III และ IV ไอโซฟอร์ม Hexokinase I, II และ III มีน้ำหนักโมเลกุลประมาณ 100, 000 และเป็นโมโนเมอร์ในสภาพส่วนใหญ่
ลำดับกรดอะมิโนของไอโซฟอร์ม I-III เท่ากับ 70% ในอีกทางหนึ่งการแบ่งขั้ว N-C และ C-terminal ของ I-III isoforms มีลำดับกรดอะมิโนที่คล้ายกันซึ่งอาจเป็นผลมาจากการทำสำเนายีนและฟิวชั่น
isoform IV ของ hexokinase (glucokinase) มีน้ำหนักโมเลกุล 50, 000 คล้ายกับยีสต์ hexokinase Glucokinase แสดงลำดับความคล้ายคลึงที่สำคัญกับ N และ C-terminal ครึ่งหนึ่งของไอโซฟอร์ม I-III
แม้จะมีความคล้ายคลึงกันตามลำดับ แต่คุณสมบัติเชิงหน้าที่ของ hexokinase isoforms นั้นแตกต่างกันอย่างมีนัยสำคัญ
Isoform I (ต่อไปนี้ hexokinase I) ควบคุมขั้นตอนการ จำกัด glycolysis ในสมองและเซลล์เม็ดเลือดแดง
ผลิตภัณฑ์ปฏิกิริยา, กลูโคส -6- ฟอสเฟต (Gluc-6-P), ยับยั้งทั้งสอง isoforms I และ II (แต่ไม่ใช่ isoform IV) ที่ระดับ micromolar
อย่างไรก็ตามอนินทรีย์ฟอสเฟต (Pi) ช่วยลดการยับยั้ง Gluc-6-P จาก hexokinase I
โดเมน C-terminal ของ hexokinase I มีกิจกรรมการเร่งปฏิกิริยาในขณะที่โดเมน N-terminal นั้นไม่มีกิจกรรม แต่มีส่วนเกี่ยวข้องในการควบคุม allosteric เชิงบวกของผลิตภัณฑ์โดย Pi
ในทางตรงกันข้ามชิ้นส่วน C และ N-terminal มีกิจกรรมการเร่งปฏิกิริยาที่คล้ายกันใน isoform II
ดังนั้นในบรรดาไอโซฟอร์มของ hexokinase นั้น hexokinase ในสมองจะแสดงคุณสมบัติที่เป็นเอกลักษณ์ซึ่งระดับทางสรีรวิทยาของ Pi สามารถย้อนกลับการยับยั้งเนื่องจากระดับสรีรวิทยาของ Gluc-6-P (Alexander E Aleshin, 1998)
Hexokineses ของ type I, II และ III สามารถ phosphorylate ความหลากหลายของน้ำตาล hexose, รวมถึงกลูโคส, ฟรุกโตสและ mannose, และเช่นนี้มีส่วนร่วมในเส้นทางการเผาผลาญจำนวนมาก (เอนไซม์ของ Glycolysis, SF)
glucokinase ของตับแตกต่างจาก isoforms อื่น ๆ ในสามด้าน:
- มันมีความเฉพาะสำหรับ D-กลูโคสและไม่ได้ทำกับ hexoses อื่น ๆ
- มันไม่ได้ถูกยับยั้งโดยกลูโคส 6-phosphate
- มันมีกิโลเมตรสูงกว่าไอโซฟอร์มอื่น ๆ (10mM เทียบกับ 0.1mM) ซึ่งให้ความสัมพันธ์กับพื้นผิวที่ต่ำกว่า
ตับ glucokinase เข้ามาเล่นเมื่อความเข้มข้นของน้ำตาลในเลือดสูงตัวอย่างเช่นหลังจากมื้ออาหารที่อุดมด้วยคาร์โบไฮเดรต
กลูโคนิเนสมีความสำคัญในด้านอื่น: โรคเบาหวานมีความบกพร่องในการเกิดโรค
ในโรคนี้ตับอ่อนไม่สามารถหลั่งอินซูลินในปริมาณปกติระดับน้ำตาลในเลือดสูงมากและไกลโคเจนในตับเกิดขึ้นน้อยมาก (Lehninger, 1982)