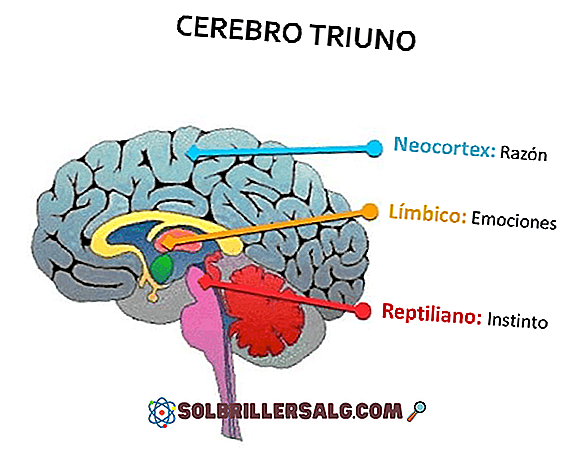
เอนทาลปีคืออะไร
Enthalpy เป็นการวัดปริมาณพลังงานที่มีอยู่ในร่างกาย (ระบบ) ที่มีปริมาตรอยู่ภายใต้ความกดดันและสามารถปรับให้เข้ากับสภาพแวดล้อมของมัน มันถูกแทนด้วยตัวอักษร H หน่วยทางกายภาพที่เกี่ยวข้องกับมันคือกรกฎาคม (J = kgm2 / s2)
ในทางคณิตศาสตร์มันสามารถแสดงได้ดังนี้
H = U + PV
ที่อยู่:
H = Enthalpy
U = พลังงานภายในของระบบ
P = ความดัน
V = ปริมาณ
หากทั้ง U และ P และ V เป็นฟังก์ชั่นของรัฐ H ก็จะเหมือนกัน นี่เป็นเพราะในช่วงเวลาที่กำหนดเงื่อนไขสุดท้ายและเริ่มต้นของตัวแปรที่จะได้รับการศึกษาในระบบสามารถได้รับ
เอนทัลปีของการก่อตัวคืออะไร?
มันคือความร้อนที่ถูกดูดซับหรือถูกปล่อยออกมาโดยระบบเมื่อ 1 โมลของผลิตภัณฑ์ของสารถูกผลิตจากองค์ประกอบในสถานะปกติของการรวมตัว; ของแข็งของเหลวก๊าซละลายหรืออยู่ในสถานะ allotropic ที่มีเสถียรภาพมากขึ้น
สถานะ allotropic ที่เสถียรที่สุดของคาร์บอนคือแกรไฟต์นอกเหนือจากการอยู่ในสภาวะความดันปกติ 1 บรรยากาศและอุณหภูมิ 25 ° C
มันแสดงว่าΔH° f ด้วยวิธีนี้:
ΔH° f = final H - Initial H
Δ: ตัวอักษรกรีกที่เป็นสัญลักษณ์ของการเปลี่ยนแปลงหรือการเปลี่ยนแปลงในพลังงานของรอบชิงชนะเลิศและสถานะเริ่มต้น ตัวห้อย f หมายถึงการก่อตัวของสารประกอบและเงื่อนไขตัวยกหรือมาตรฐาน
ตัวอย่าง
พิจารณาปฏิกิริยาการก่อตัวของน้ำของเหลว
H2 (g) + ½ O2 (g) H2O (l) ΔH° f = -285.84 kJ / mol
สารรีเอเจนต์ : ไฮโดรเจนและออกซิเจนสถานะทางธรรมชาติของมันเป็นก๊าซ
ผลิตภัณฑ์ : น้ำของเหลว 1 โมล
มันควรจะสังเกตว่า enthalpies ของการก่อตัวตามคำนิยามสำหรับ 1 โมลของสารประกอบที่ผลิตดังนั้นควรปรับปฏิกิริยาถ้าเป็นไปได้ด้วยค่าสัมประสิทธิ์เศษส่วนตามที่เห็นในตัวอย่างก่อน
ปฏิกิริยาคายความร้อนและความร้อน
ในกระบวนการทางเคมีเอนทาลปีของการก่อตัวอาจเป็นบวกΔHof> 0 ถ้าปฏิกิริยานั้นเป็นสารดูดความร้อนซึ่งหมายความว่ามันดูดซับความร้อนจากตัวกลางหรือลบ <Hof <0 ถ้าปฏิกิริยาคายความร้อนด้วยการปล่อยความร้อนออกจากระบบ
ปฏิกิริยาคายความร้อน
รีเอเจนต์มีพลังงานมากกว่าผลิตภัณฑ์
ΔH° f <0
ปฏิกิริยาดูดความร้อน
รีเอเจนต์มีพลังงานต่ำกว่าผลิตภัณฑ์
ΔH° f> 0
ในการเขียนสมการทางเคมีอย่างถูกต้องจะต้องมีความสมดุลของโมลาร์ เพื่อให้สอดคล้องกับ "กฎหมายการอนุรักษ์สสาร" จะต้องมีข้อมูลเกี่ยวกับสถานะทางกายภาพของรีเอเจนต์และผลิตภัณฑ์ซึ่งเป็นที่รู้จักกันในชื่อสถานะการรวมตัว
มันจะต้องเป็นพาหะในใจว่าสารบริสุทธิ์มีเอนทัลปีของการก่อตัวจากศูนย์ถึงเงื่อนไขมาตรฐานและในรูปแบบที่มั่นคงที่สุดของพวกเขา
ในระบบเคมีที่มีสารตั้งต้นและผลิตภัณฑ์เรามีว่าเอนทาลปีของปฏิกิริยาเท่ากับเอนทาลปีของการก่อตัวภายใต้เงื่อนไขมาตรฐาน
ΔH° rxn = ΔH° f
คำนึงถึงข้างต้นเราต้อง:
ΔH° rxn = Σnproductos Hivectivos Σnreactivos Hreactivos
ได้รับปฏิกิริยาที่สมมติขึ้นดังต่อไปนี้
aA + bB cC
โดยที่ a, b, c คือสัมประสิทธิ์ของสมการทางเคมีที่สมดุล
นิพจน์สำหรับเอนทาลปีของปฏิกิริยาคือ:
Δ H ° rxn = c Δ H ° f C (a Δ H ° f A + b Δ H ° f B)
สมมติว่า: a = 2 mol, b = 1 mol และ c = 2 mol
ΔH° f (A) = 300 KJ / mol, ΔH° f (B) = -100 KJ / mol, ΔH° f (C) = -30 KJ คำนวณΔ H ° rxn
Δ H ° rxn = 2mol (-30KJ / mol) - (2mol (300KJ / mol + 1mol (-100KJ / mol) = -60KJ - (600KJ - 100KJ) = -560KJ
Δ H ° rxn = -560KJ
สอดคล้องกับปฏิกิริยาคายความร้อน
ค่าเอนทัลปีสำหรับการก่อตัวของสารประกอบอนินทรีย์และสารเคมีอินทรีย์บางชนิดที่ความดัน 25 ° C และ 1 atm

แบบฝึกหัดในการคำนวณเอนทาลปี
แบบฝึกหัดที่ 1
ค้นหาเอนทาลปีของการเกิดปฏิกิริยาของ NO2 (g) ตามปฏิกิริยาต่อไปนี้:
2NO (g) + O2 (g) 2NO2 (g)
การใช้สมการสำหรับเอนทาลปีของปฏิกิริยาเรามี:
ΔH° rxn = Σnproductos Hivectivos Σnreactivos Hreactivos
ΔH° rxn = 2mol (ΔH° f NO2) - (2mol ΔH° f NO + 1mol ΔH° f O2)
ในตารางในส่วนก่อนหน้านี้เราจะเห็นได้ว่าเอนทาลปีของการก่อตัวของออกซิเจนคือ 0 KJ / mol เพราะออกซิเจนเป็นสารประกอบบริสุทธิ์
ΔH° rxn = 2mol (33.18KJ / mol) - (2mol 90.25 KJ / mol + 1mol 0)
ΔH° rxn = -114.14 KJ
อีกวิธีในการคำนวณเอนทาลปีของปฏิกิริยาในระบบเคมีคือ LAW OF HESS ซึ่งเสนอโดยนักเคมีชาวสวิสชาวเยอรมัน Germain Henri Hess ในปี ค.ศ. 1840
กฎหมายกล่าวว่า: "พลังงานที่ถูกดูดซับหรือปล่อยออกมาในกระบวนการทางเคมีที่สารตั้งต้นกลายเป็นผลิตภัณฑ์จะเหมือนกันถ้ามันถูกนำไปใช้ในขั้นตอนเดียวหรือหลายครั้ง"
แบบฝึกหัดที่ 2
การเติมไฮโดรเจนกับอะเซทิลีนในรูปแบบอีเทนสามารถทำได้ในขั้นตอนเดียว:
C2H2 (g) + 2H2 (g) H3CCH3 (g) ΔH° f = - 311.42 KJ / mol
หรืออาจเกิดขึ้นในสองขั้นตอน:
C2H2 (g) + H2 (g) H2C = CH2 (g) ΔH° f = - 174.47 KJ / mol
H2C = CH2 (g) + H2 (g) H3CCH3 (g) ΔH° f = - 136.95 KJ / mol
โดยการเพิ่มสมการทั้งสองเกี่ยวกับพีชคณิตเรามี:
C2H2 (g) + H2 (g) H2C = CH2 (g) ΔH° f = - 174.47 KJ / mol
H2C = CH2 (g) + H2 (g) H3CCH3 (g) ΔH° f = - 136.95 KJ / mol
C2H2 (g) + 2H2 (g) H3CCH3 (g) ΔH° rxn = 311.42 KJ / mol
แบบฝึกหัด 3
(นำมาจาก quimitube.com แบบฝึกหัด 26. กฎหมายอุณหพลศาสตร์ Hess's)
คำนวณเอนทาลปีของการออกซิเดชั่นของเอธานอลเพื่อให้กรดอะซิติกและน้ำเป็นผลิตภัณฑ์โดยรู้ว่าในการเผาไหม้ของเอทานอล 10 กรัมจะปล่อยพลังงาน 300 KJ และในการเผาไหม้ของกรดอะซิติก 10 กรัมพลังงาน 140 กิโลจูล
อย่างที่สามารถเห็นได้ในคำแถลงปัญหามีเพียงข้อมูลตัวเลขปรากฏ แต่ปฏิกิริยาทางเคมีไม่ปรากฏดังนั้นจึงจำเป็นต้องเขียนมัน
CH 3 CH 2 OH (l) + 3O 2 (g) 2CO 2 (g) + 3 H 2 O (l) ΔH 1 = -1380 KJ / mol
ค่าของเอนทาลปีเชิงลบถูกเขียนขึ้นเนื่องจากปัญหาบอกว่ามีการปล่อยพลังงาน คุณต้องพิจารณาว่าเป็นเอทานอล 10 กรัมดังนั้นคุณต้องคำนวณพลังงานสำหรับแต่ละโมลของเอทานอล สำหรับสิ่งนี้จะทำสิ่งต่อไปนี้:
น้ำหนักโมลาร์ของเอทานอล (ผลรวมของน้ำหนักอะตอม) มีค่าเท่ากับ 46 g / mol
Δ H1 = -300 KJ (46 กรัม) เอทานอล = - 1380 KJ / mol
10 กรัมเอทานอล 1mol เอทานอล
เช่นเดียวกับกรดอะซิติก:
CH 3 COOH (l) + 2O 2 (g) 2CO 2 (g) + 2 H 2 O (l) ΔH 2 = -840 KJ / mol
Δ H2 = -140 KJ (กรดอะซิติก 60 กรัม) = - 840 KJ / mol
กรดอะซิติก 10 กรัมกรดอะซิติก 1 โมล
ในปฏิกิริยาข้างต้นอธิบายถึงการเผาไหม้ของเอธานอลและกรดอะซิติกดังนั้นจึงจำเป็นต้องเขียนสูตรปัญหาซึ่งก็คือการเกิดออกซิเดชันของเอทานอลกับกรดอะซิติกด้วยการผลิตน้ำ
นี่คือปฏิกิริยาที่ปัญหาถาม มันมีความสมดุลอยู่แล้ว
CH 3 CH 2 OH (l) + O 2 (g) CH 3 COOH (l) + H 2 O (l) ΔH 3 =?
การใช้กฎหมายของเฮสส์
ในการทำเช่นนี้เราคูณสมการทางอุณหพลศาสตร์โดยสัมประสิทธิ์เชิงตัวเลขเพื่อทำให้พวกเขาเกี่ยวกับพีชคณิต สิ่งนี้ทำเมื่อรีเอเจนต์หนึ่งตัวหรือมากกว่านั้นไม่ได้อยู่ในด้านที่สอดคล้องกันในสมการ
สมการแรกยังคงเหมือนเดิมเพราะเอธานอลอยู่ด้านข้างของตัวทำปฏิกิริยาตามที่ระบุโดยสมการปัญหา
สมการที่สองจำเป็นต้องคูณด้วยสัมประสิทธิ์ -1 ในลักษณะที่ว่ากรดอะซิติกที่มีปฏิกิริยาสามารถกลายเป็นผลิตภัณฑ์ได้
CH 3 CH 2 OH (l) + 3O 2 (g) 2CO 2 (g) + 3H 2 O (1) ΔH 1 = -1380 KJ / mol
- CH 3 COOH (l) - 2O 2 (g) - 2CO 2 (g) - 2H 2 O (l) ΔH 2 = - (-840 KJ / mol)
CH 3 CH 3 OH + 3O 2 -2O 2 - CH 3 COOH 2CO 2 + 3H 2 O -2CO 2
-2H2O
พวกเขาจะถูกเพิ่มพีชคณิตและนี่คือผลลัพธ์: สมการที่ร้องขอในปัญหา
CH 3 CH 3 OH (l) + O 2 (g) CH 3 COOH (l) + H 2 O (l)
กำหนดเอนทาลปีของปฏิกิริยา
ในทำนองเดียวกับที่แต่ละปฏิกิริยาคูณด้วยสัมประสิทธิ์เชิงตัวเลขค่าของเอนทาลปีก็จะต้องคูณด้วย
ΔH3 = 1x ΔH1-1xΔH2 = 1x (-1380) -1x (-840)
ΔH3 = -1380 + 840 = - 540 KJ / mol
ΔH3 = - 540 KJ / mol
ในการออกกำลังกายก่อนหน้านี้เอทานอลมีสองปฏิกิริยาการเผาไหม้และออกซิเดชัน
ในปฏิกิริยาการเผาไหม้ทุกครั้งจะมีการก่อตัวของ CO2 และ H2O ในขณะที่ออกซิเดชันของแอลกอฮอล์หลักเช่นเอทานอลจะมีการก่อตัวของกรดอะซิติก