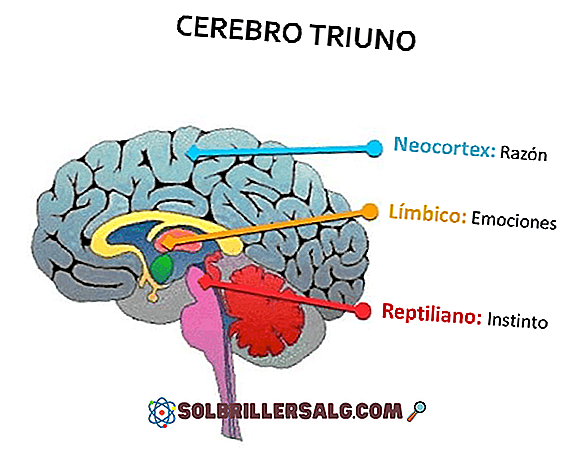
Molality คืออะไร (พร้อมตัวอย่าง)
Molality ซึ่งแทนด้วยตัวอักษร m ในตัวพิมพ์เล็กเป็นคำที่ใช้อธิบายความเข้มข้นของสารละลาย มันสามารถกำหนดเป็นจำนวนโมลของตัวถูกละลายละลายใน 1 กิโลกรัมของตัวทำละลาย
มันเท่ากับโมลของตัวถูกละลาย (สารที่ละลาย) หารด้วยกิโลกรัมของตัวทำละลาย (สารที่ใช้ในการละลาย) (Molality Formula, SF)

ในกรณีที่มีโมลของตัวถูกละลายโดยสมการ:

สำหรับขั้นสุดท้ายสมการ molality คือ

ลักษณะของการผิดปรกติ
Molality เป็นการวัดความเข้มข้นของตัวถูกละลายในสารละลาย ส่วนใหญ่จะใช้เมื่ออุณหภูมิเป็นข้อกังวล (หมายเหตุวิทยาศาสตร์และโครงการ, 2015)
Molality ไม่เหมือนกับสามัญโมลาร์ (โมลของตัวถูกละลายต่อตัวทำละลายลิตร) แต่มันถูกใช้ในการคำนวณที่เฉพาะเจาะจงมากโดยเฉพาะอย่างยิ่งในเรื่องของคุณสมบัติ colligative (จุดเดือดสูงขึ้นจุดซึมเศร้า แช่แข็ง)
เนื่องจากปริมาตรอาจเปลี่ยนแปลงได้เนื่องจากอุณหภูมิและความดันโมลาริตีจึงแปรผันตามอุณหภูมิและความดัน ในบางกรณีการใช้น้ำหนักเป็นข้อได้เปรียบเพราะมวลไม่แตกต่างกันไปตามสภาพแวดล้อม
เป็นสิ่งสำคัญที่จะต้องใช้มวลตัวทำละลายไม่ใช่มวลของสารละลาย วิธีแก้ปัญหาที่ทำเครื่องหมายด้วยความเข้มข้น molal จะแสดงด้วยตัวพิมพ์เล็ก m วิธีแก้ปัญหาที่ 1.0 ม. ประกอบด้วย 1 โมลของตัวถูกละลายต่อกิโลกรัมของตัวทำละลาย
การเตรียมสารละลาย molality ที่ให้นั้นเป็นเรื่องง่ายเพราะมันต้องการแค่ระดับที่ดีเท่านั้น ทั้งตัวทำละลายและตัวทำละลายผสมกันแทนที่จะถูกวัดโดยปริมาตร
หน่วย SI (ระบบระหว่างประเทศ) สำหรับ molality คือ mol / kg หรือโมลละลายต่อกิโลกรัมของตัวทำละลาย วิธีแก้ปัญหาที่มีค่า molality 1 mol / kg มักจะอธิบายว่า "1 molal" หรือ "1 m"
อย่างไรก็ตามตามระบบหน่วย SI สถาบันมาตรฐานและเทคโนโลยีแห่งชาติซึ่งเป็นหน่วยงานด้านการวัดของสหรัฐอเมริกาพิจารณาว่าคำว่า "โมลาล" และสัญลักษณ์หน่วย "m" นั้นล้าสมัยและแนะนำให้ใช้ โมล / กก. (ไร้ขอบเขต, SF)
ความแตกต่างและความคล้ายคลึงกันระหว่าง molality (m) และ molarity (M)
การเตรียมสารละลายของ molality ที่กำหนดนั้นเกี่ยวข้องกับการชั่งน้ำหนักทั้งตัวถูกละลายและตัวทำละลายและการรับมวล
แต่ในกรณีของโมลาริตีปริมาณของสารละลายจะถูกวัดซึ่งทำให้มีที่ว่างสำหรับการแปรผันของความหนาแน่นซึ่งเป็นผลมาจากสภาพแวดล้อมของอุณหภูมิและความดัน
ซึ่งหมายความว่าเป็นประโยชน์ในการทำงานกับ molality ที่เกี่ยวข้องกับแป้งเพราะในองค์ประกอบทางเคมีมวลของสารบริสุทธิ์ที่รู้จักมีความสำคัญมากกว่าปริมาณเนื่องจากปริมาณสามารถเปลี่ยนแปลงได้ภายใต้ผลกระทบของอุณหภูมิและความดันในขณะที่ มวลยังคงไม่เปลี่ยนแปลง
นอกจากนี้ปฏิกิริยาทางเคมียังเกิดขึ้นในสัดส่วนของมวลและไม่ใช่ปริมาณ เพื่อให้เป็นไปตามมวล molality สามารถแปลงเป็นอัตราส่วนมวลหรือเศษส่วนมวลได้ง่าย (Molality คืออะไร, SF)
สำหรับสารละลายน้ำ (สารละลายที่เป็นตัวทำละลาย) ใกล้กับอุณหภูมิห้องความแตกต่างระหว่างสารละลายกรามกับกรามนั้นไม่มีความสำคัญ
นี่เป็นเพราะรอบ ๆ อุณหภูมิน้ำมีความหนาแน่น 1 กิโลกรัม / ลิตรซึ่งหมายความว่า "ต่อ L" ของโมลาริตีเท่ากับ "ต่อกิโลกรัม" ของการหลอมเหลว
สำหรับตัวทำละลายเช่นเอทานอลซึ่งมีความหนาแน่น 0.789 กิโลกรัมต่อลิตรสารละลาย 1 เมตรจะเป็น 0.789 เมตร
ส่วนสำคัญของการจดจำความแตกต่างคือ:
Molarity - M →โมลต่อลิตรของสารละลาย
Molality - m → moles ต่อกิโลกรัมของตัวทำละลาย (Helmenstine, 2017)
ตัวอย่างของ molality
ตัวอย่างที่ 1:
ปัญหา : การละลายของสารละลายที่มี NaCl 0.086 โมลละลายใน 25.0 กรัมของน้ำคืออะไร? (Bhardwaj, 2014)
คำตอบ : ในตัวอย่างนี้ใช้สมการโดยตรงของ molality:

โมลของตัวถูกละลาย (NaCl) = 0.086 mol
มวล (น้ำ) = 25.0 กรัม = 25.0 x 10-3 กิโลกรัม
การทดแทนคุณมี:

ตัวอย่างที่ 2:
ปัญหา : การละลายของสารละลายคืออะไรถ้า NaOH 124.2 กรัมละลายในน้ำ 1.00 ลิตร? (ความหนาแน่นของน้ำเท่ากับ 1.00 g / ml)
คำตอบ : น้ำเป็นที่รู้จักในฐานะตัวทำละลายสากลและความหนาแน่นมักจะได้รับ 1.00 กรัมต่อมิลลิลิตรหรือ 1 กิโลกรัมต่อลิตรเหมือนกัน สิ่งนี้จะช่วยให้การแปลงลิตรเป็นกิโลกรัม (Molality, SF)
ในปัญหานี้จะต้องเปลี่ยน NaOH 124.2 กรัมเป็นโมล (สำหรับโมลของตัวถูกละลาย) และน้ำหนึ่งลิตรจะต้องถูกเปลี่ยนเป็นกิโลกรัม (ต่อกิโลกรัมของตัวทำละลาย) โดยใช้ความหนาแน่น
อย่างแรกคือมีมวลโมลาร์ของ NaOH:
PM Na = 22.99 g / mol
PM O = 16 g / mol
PM H = 1g / mol
PM NaOH = 22.99 g / mol + 16 g / mol +1 g / mol = 39.99 g / mol
ประการที่สองกรัมของ NaOH จะถูกแปลงเป็นโมลโดยใช้มวลโมลาร์:

ประการที่สามลิตรของน้ำจะถูกแปลงเป็นกิโลกรัมโดยใช้ความหนาแน่น

การล้างแป้ง

ในที่สุดสมการ molality ได้รับการแก้ไข:

ตัวอย่างที่ 3:
ปัญหา : มวลน้ำของสารละลายน้ำที่มีแบเรียมคลอไรด์ 0.52 กรัม (BaCl 2, MW = 208.23 g / mol) ที่มีความเข้มข้น 0.005 mol / kg คืออะไร
ตอบ : ในกรณีนี้ความเข้มข้นของโมลจะถูกใช้เพื่อกำหนดปริมาณของน้ำในสารละลาย
ก่อนอื่นจำนวนของโมลของ BaCl 2 ในสารละลายจะได้รับ:

ประการที่สองกิโลกรัมของตัวทำละลายจะถูกลบออกจากสมการ molality และแก้ไข